GETTY IMAGES - Avanços tecnológicos aplicados à medicina vêm aumentando nossa compreensão do genoma humano a um ritmo acelerado
BBC
A busca para entender como nossos genes funcionam começou em meados do século 19, quando o biólogo e monge Gregor Mendel chegou a uma conclusão surpreendente sobre as características das plantas.
Mendel cruzou pés de ervilha de flores roxas com outros de flores brancas e verificou que os pés resultantes possuíam flores roxas.
Por outro lado, surpreendeu-se ao descobrir que a terceira geração apresentava flores de ambas as cores.
Isso revelou uma característica importante sobre as plantas: a de que as cores podem ser herdadas, porém uma pode ser mais dominante do que a outra.
De certa forma, Mendel descobriu como os genes atuam. Mas não o que eram ou ao que se pareciam.
 GETTY IMAGES - Para sua descoberta sobre o DNA, Watson e Crick se basearam no trabalho de Rosalind Franklin (à dir.) e Maurice Wilkins
GETTY IMAGES - Para sua descoberta sobre o DNA, Watson e Crick se basearam no trabalho de Rosalind Franklin (à dir.) e Maurice Wilkins
Tal resposta chegou muito mais tarde. Foi apenas no século seguinte que a própria estrutura do DNA foi descoberta. Em 1953, com base no trabalho de Rosalind Franklin e Maurice Wilkins, os cientistas James Watson e Francis Crick descobriram que nosso DNA é formado por uma estrutura em dupla hélice.
Foi um avanço significativo. Conhecer essa estrutura ajudou a revelar mais segredos. Quando o DNA é replicado, essa hélice se divide em duas.

Como o DNA abriu caminho para o tratamento das doenças mais mortíferas?
Isso significa que mutações podem acontecer à medida que nossas células se dividem. Mesmo um pequeno defeito genético pode, assim, causar uma doença devastadora.
Em outras palavras, o "livro" que representa cada um de nós pode ser impresso ou reescrito com erros. Mas agora temos as ferramentas - incluindo a capacidade de analisar grandes conjuntos de dados - para ler esse livro mais rápido, mais barato e até mesmo interagir com ele.
 GETTY IMAGES - James Watson foi um dos cientistas que descobriram estrutura de dupla hélice do DNA
GETTY IMAGES - James Watson foi um dos cientistas que descobriram estrutura de dupla hélice do DNA
Editando Genes
Cientistas já são capazes de editar genes de organismos - e essa edição vem sendo usada para tratar algumas doenças devastadoras com grande sucesso.
No entanto, o processo é muitas vezes demorado e dispendioso.
Apenas cinco anos atrás, uma forma de edição de genes foi descoberta com grande pompa. É chamada CRISPR Cas9, ou apenas CRISPR. Em outras palavras, a CRISPR usa "tesouras moleculares" para alterar um trecho muito específico de DNA - cortando-o, substituindo-o ou aperfeiçoando-o.
Atualmente, a técnica é usada em laboratórios de todo o mundo a partir da alteração e manipulação dos genes de plantas e animais. A expectativa é de que ela possa ser usada em breve para tratar numerosas doenças humanas.
"O que interessa à opinião pública é a possibilidade de usar a edição de genes CRISPR para fins terapêuticos", diz o professor Robin Ali, da Sociedade Europeia para Genética e Terapia Celular. Isso pode acontecer dentro da próxima década, se estudos iniciais forem promissores.
style="display:block; text-align:center;" data-ad-layout="in-article" data-ad-format="fluid" data-ad-client="ca-pub-6652631670584205" data-ad-slot="1871484486"> Intellia Therapeutics é uma das várias companhias que desenvolvem tecnologia CRISPR para uso em seres humanos | Foto: Intellia
Intellia Therapeutics é uma das várias companhias que desenvolvem tecnologia CRISPR para uso em seres humanos | Foto: Intellia
Os primeiros testes em humanos já estão em andamento na China e receberam aprovação para serem conduzidos nos EUA.
Nesses experimentos, cientistas injetaram células modificadas em pacientes que haviam sido previamente removidas, em vez de editar células dentro deles diretamente. Se as células fossem diretamente modificadas dentro do próprio corpo, muitos outros distúrbios genéticos poderiam ser tratados.
Apesar disso, eles continuam entusiasmados com a tecnologia, que poderia fornecer tratamentos efetivos para condições atualmente ainda não tratáveis, como a doença de Huntington e a fibrose cística, para citar apenas duas. Em teoria, a CRISPR poderia oferecer tratamentos rapidamente, em questão de dias ou semanas, em vez de meses.
"Há muito poucos exemplos em que uma nova tecnologia se disseminou em laboratórios em todo o mundo, onde é implementada para fazer coisas extremamente difíceis de fazer", diz Ali.
O uso da CRISPR não será, no entanto, "instantânea", alerta o pesquisador.
Segundo Ali, serão necessários vários anos para que a tecnologia seja usada clinicamente.
A Intellia Therapeutics é uma das várias companhias que desenvolvem essa tecnologia para uso em seres humanos. O CEO da empresa, Nessan Bermingham, acredita que a CRISPR tem o potencial de revolucionar completamente a medicina.
A expectativa é de que a técnica poderia ser usada em doenças causadas por apenas um gene defeituoso, bem como doenças causadas por mais de uma mutação genética.

Tecnologia de edição de genes usa 'tesouras moleculares'
"Essa tecnologia tem o potencial de nos permitir atuar sobre vários trechos de DNA ao mesmo tempo", diz Bermingham.
Segundo ele, estudos realizados pela Intellia revelaram que uma única injeção em um animal pode retardar a produção de uma proteína tóxica em 97%.
Antes que possa ser usada em humanos, no entanto, qualquer droga terá que ser amplamente testada e regulamentada pelas autoridades. Até então, será principalmente uma ferramenta de pesquisa no laboratório. "Sem dúvida, o poder (do CRISPR) é sua facilidade para editar genomas", diz Ali.
Muitas questões científicas ainda precisam ser respondidas antes que a Intellia possa buscar aprovação para testes clínicos em humanos. Por esse motivo, Bermingham hesita em propor uma data específica.
O dinheiro, por outro lado, continua a fluir. Embora a Intellia esteja atualmente envolvida em uma batalha para obter a patente da CRISPR, Bermingham diz que isso não afastou investidores.
"Do ponto de vista do investidor, do ponto de vista científico, as pessoas estão analisando essas descobertas e dizendo "agora temos a ferramenta, estamos prontos para seguir adiante", destaca.
 INTELLIA - Intellia tenta obter patente da técnica conhecida como CRISPR | Foto: Intellia
INTELLIA - Intellia tenta obter patente da técnica conhecida como CRISPR | Foto: Intellia
O procedimento também desperta polêmica. Especialmente no que se refere aos chamados "bebês sob medida".
Apesar disso, é importante notar que alterar o DNA de um indivíduo só vai alterar os genes específicos que estão sendo editados. A mudança não será transmitida a seus descendentes. Esse processo é conhecido como edição somática.
A polêmica surge, no entanto, quando se editam embriões humanos unicelulares - caso resultem em gravidez. Testes desse tipo já estão ocorrendo, mas apenas para fins de pesquisa.
A Intellia se concentra, por sua vez, na edição de genes somáticos.
"Qualquer discussão sobre a edição de linha germinativa - nas quais essas células ou essas edições são passadas para seus filhos e filhos de seus filhos - é prematura", diz Bermingham.
Daqui a algum tempo, será possível analisar quão bem sucedidos os testes em humanos serão. Só então entenderemos se a CRISPR será um divisor de águas para doenças humanas, como se prevê.
 A CRISPR pode ser usada para uma variedade de doenças genéticas, incluindo câncer | Foto: Intellia
A CRISPR pode ser usada para uma variedade de doenças genéticas, incluindo câncer | Foto: Intellia
Tratamentos inteligentes
Enquanto a CRISPR pode ser usada para tratar uma série de doenças genéticas, incluindo o câncer, existem muitas outras empresas de olho em tipos específicos de câncer.
Há, atualmente, mais de 200 tipos de câncer, o que torna muito difícil seu tratamento.
Mas uma tecnologia recém-lançada vem usando o próprio sistema imunológico do paciente para combater a doença.
Nosso sistema imunológico é muito eficiente em enfrentar infecções. Na linha de frente, estão as células brancas chamadas "células T", que buscam especificamente por sinais de infecção. Ao detectarem um vírus, elas se multiplicam e o atacam.
O problema é que as células T não reconhecem mutações cancerosas como inimigos invasivos, pois são, em última análise, versões "mutantes" das próprias células do paciente.
"Há muito tempo, a medicina queria reorientá-las para aniquilar tumores", explica Martin Pule, da University College de Londres.
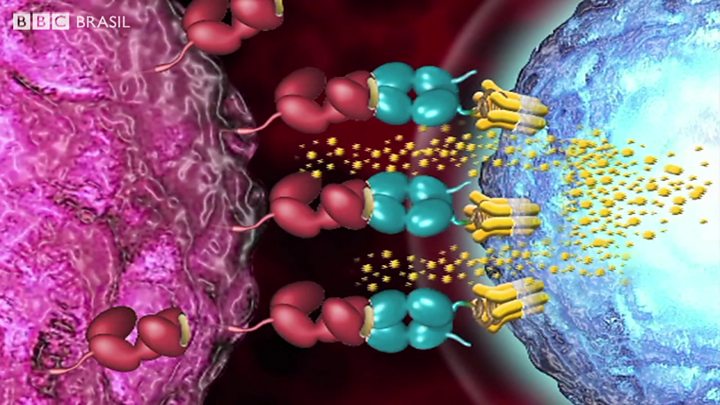
Terapia usa o próprio sistema imunológico do paciente para tratar o câncer
Pule e seus colegas já conseguiram fazer isso alterando geneticamente as células T para reconhecer e atacar o câncer. Uma dessas terapias, chamada CAR-T, já foi licenciada para uso nos EUA, com um custo de US$ 475 mil (R$ 1,5 milhão) por paciente. O tratamento personalizado se volta para crianças e jovens com leucemia linfoblástica aguda.
Segundo o laboratório farmacêutico Novartis, que fabricou a droga, a taxa de remissão é de 83%.
"Nunca houve nada do tipo na história recente", diz Pule.
Ele vê esse tipo de tratamento como o futuro da oncologia, com nove testes clínicos atualmente em andamento na University College de Londres. Várias empresas também estão trabalhando em tratamentos que aproveitam o poder das células T, entre elas a Autolus e a Immunocore, ambas no Reino Unido, e a Novartis, nos EUA.
A Immunocore, sediada em Oxford, na Inglaterra, usa uma tecnologia chamada terapia TCR - a partir da qual uma pequena molécula atrai as células T e as cancerosas. Uma vez que ambas as células estão conectadas, permite que as células T liberem toxinas para matar o câncer.
Essa molécula foi desenvolvida para tratar um tipo raro de câncer que pode se espalhar rapidamente para o fígado. Quando isso acontece, os pacientes têm pouco tempo de vida. O medicamento visa tratar, portanto, tumores hepáticos. Já foram 180 pacientes tratados com resultados promissores, segundo a Immunocore.
 Eva-Lotta Allan, CEO da Immunocore, espera que medicamento para tipo raro de câncer chegue às farmácias nos próximos dois anos | Foto: Immunocore
Eva-Lotta Allan, CEO da Immunocore, espera que medicamento para tipo raro de câncer chegue às farmácias nos próximos dois anos | Foto: Immunocore
Eva-Lotta Allan, CEO da empresa, espera que o medicamento chegue às farmácias nos próximos dois anos.
"Aumentamos a taxa de sobrevivência após um ano de tratamento em quase quatro vezes, em comparação com outros (tratamentos) lá fora hoje", diz.
Se for eficaz, a tecnologia também pode ser usada para tratar doenças infecciosas, como o HIV, a tuberculose e doenças autoimunes.
Allan conta que muitos dos investidores da Immunocore, incluindo a Fundação Bill e Melinda Gates e vários laboratórios farmacêuticos, permitiram à empresa passar muitos anos trabalhando na fabricação de uma droga para tratar um tipo tão raro de câncer, dado que apenas 4 mil pacientes são diagnosticados a cada ano com a doença, o que poderia acabar por inibir o investimento.
"Grandes laboratórios farmacêuticos com uma perspectiva exclusivamente comercial podem pensar que o investimento não vale a pena."
Arma contra a malária
E não são apenas mutações genéticas que podem causar uma série de doenças, mas também "invasores estrangeiros".
A malária, por exemplo, mata quase meio milhão de pessoas por ano em todo o mundo. Há várias cepas da doença que, devido à sua constante mutação, acabam tornando mais difícil o tratamento.
Para entender como o parasita da malária criou resistência a medicamentos, os cientistas costumam analisar sua diversidade genética.
Agora esse tipo de análise também é possível em áreas remotas, com um dispositivo manual de sequenciamento chamado Nanopore MinION.
Jane Carlton, professora-adjunta do Departamento de Microbiologia da Universidade de Nova York, recorre a um deles para ajudá-la a entender como a malária leva a melhor sobre o tratamento.
Usando apenas um laptop e o Minion, que é do tamanho de um telefone celular e custa US$ 1 mil (R$ 3,2 mil), Carlton pode sequenciar o genoma do parasita da malária em algumas horas.

Dispositivo portátil é capaz de sequenciar o genoma dos parasitas da malária
Trata-se do mesmo resultado obtido a partir das imensas máquinas de sequenciamento do tamanho de geladeiras que ela possui em seu laboratório, que exigem maior manutenção. Isso sem falar no vai e vém das amostras.
A tecnologia permite a Carlton entender rapidamente se o parasita será ou não resistente a certas drogas. Usando o dispositivo, ela conseguiu, por exemplo, identificar mutações resistentes a medicamentos no mesmo dia em que os pacientes foram diagnosticados com a malária.
O MinION pode ser usado para sequenciar qualquer organismo vivo, tornando-o extremamente útil para estudar rapidamente doenças devastadoras fora do laboratório. Isso ajudou os cientistas a entender mais sobre os vírus Ebola e Zika. O dispositivo chegou a ser usado, inclusive, para sequenciar o genoma humano.
Outra pesquisadora que se beneficiou do aparelho é Kim Judge, cientista de estatísticas sênior do Wellcome Trust Sanger Institute, nos Estados Unidos. Ela diz que seu valor é inestimável no campo, dada sua portabilidade. Atualmente, o MinION é licenciado para fins de pesquisa, mas testes estão em andamento para ver como ele poderia diagnosticar doenças mais rapidamente do que os métodos existentes.
Já o professor Yutaka Suzuki, da Universidade de Tóquio, no Japão, descobriu o potencial do Minion como ferramenta para países em desenvolvimento.
Ele e sua equipe vem usando o dispositivo em clínicas e hospitais na província de Sulawesi do Norte, na Indonésia.
Suzuki diz que pode fazer em cinco horas o que os sequenciadores anteriores demandavam cinco dias. Isso permite aos médicos um diagnóstico rápido e preciso. "Normalmente, o paciente não pode esperar, especialmente quando infectado com perigosos agentes patogênicos... eles precisam de decisões imediatas", diz.
"E as estratégias de tratamento podem ser diferentes, dependendo dos agentes patogênicos ou se eles são resistentes a medicamentos ou não."
 MinION pode ser usado para sequenciar genoma de qualquer organismo vivo
MinION pode ser usado para sequenciar genoma de qualquer organismo vivo
Investimento maciço
Essas são apenas algumas da empresas de biotecnologia que vêm se aproveitando do rápido avanço sobre o conhecimento da genética.
Investidores estão interessados em ganhar dinheiro com tratamentos inovadores, mas os lucros não são garantidos - e muitas startups vão fracassar no primeiro momento. Muitas empresas que realizam pesquisas ainda em estágio inicial, como a Immunocore, não terão nenhum retorno por muitos anos.
Então, por que tamanho investimento?
 Professor Yutaka Suzuki, da Universidade de Tóquio, no Japão, descobriu potencial do MinION como ferramenta para países em desenvolvimento
Professor Yutaka Suzuki, da Universidade de Tóquio, no Japão, descobriu potencial do MinION como ferramenta para países em desenvolvimento
Para começar, se a droga ou o produto de uma empresa for bem-sucedido, os retornos podem ser extremamente lucrativos, explica Hitesh Thakrar, sócio do fundo de investimento Syncona, voltado para pesquisas médicas.
No caso da edição de genes, por exemplo, as estimativas sugerem que o tratamento com CRISPR poderia custar até US$ 1 milhão por paciente. O governo britânico também oferece incentivos fiscais para investimentos em negócios qualificados no âmbito do Plano de Investimento Empresarial.
"Invisto em startups à medida que mais inovações estão acontecendo de baixo para cima", diz Thakrar.
Os objetivos monetários podem ser o único fator para alguns, mas ele também está entusiasmado com os avanços de ponta no campo da medicina.
"Pela primeira vez na história da medicina, estamos prestes a curar as pessoas - é um momento bastante excitante para ser exposto em empresas que estão curando doenças em vez de sintomas", afirma ele.
Quando as empresas investem no campo das ciências apenas em busca de altos retornos financeiros, outros impactos negativos também podem ocorrer. O volume de dinheiro em jogo pode acabar tirando fundos da chamada "blue-sky research" - como é chamada a busca do conhecimento a partir da qual descobertas inesperadas e inovadoras acontecem. Alguns veem essa mudança no direcionamento das pesquisas como preocupante.
 GETTY IMAGES - Busca para entender como nossos genes funcionam começou em meados do século 19, quando Gregor Mendel chegou a conclusão surpreendente sobre características das plantas
GETTY IMAGES - Busca para entender como nossos genes funcionam começou em meados do século 19, quando Gregor Mendel chegou a conclusão surpreendente sobre características das plantas
"É um propósito ligeiramente diferente", diz Timothy Weil, biólogo molecular da Universidade de Cambridge, na Inglaterra. "Muitas startsups e investidores de risco estão tentando solucionar um problema, buscando a resposta a um conhecido desconhecido. Um dos aspectos mais excitantes da pesquisa básica do céu azul é a perspectiva das incógnitas desconhecidas."
Outro problema é que, quando as patentes estão envolvidas, as descobertas científicas nem sempre são compartilhadas com outros cientistas, apesar de muitas vezes serem pesquisadores universitários que fazem as primeiras e vitais descobertas.
O financiamento para a pesquisa acadêmica, no entanto, pode levar tempo e ser competitivo. Pule divide seu tempo entre a academia e seus negócios. Segundo ele, "o investimento industrial permite a aplicação rápida de grandes somas de dinheiro para objetivos muito singulares".
Para Pule, o CAR-T é um exemplo em que o desenvolvimento tecnológico e clínico avançou muito rapidamente. "É um bom exemplo do poder do capitalismo."
Não há dúvida, contudo, de que o investimento em tecnologia emergente está crescendo a um ritmo acelerado. É por isso que Ali acredita que nunca houve melhor momento para trabalhar na biotecnologia.
"O influxo de investimento e a criação de muitas novas empresas apenas demonstraram quanta convicção existe no que a tecnologia vai nos proporcionar."
Também mostram que os avanços na medicina podem e são provenientes de muitas áreas diferentes. "Esses são desafios geracionais. Quanto mais formas tivermos para abordar o problema, melhor a chance de encontrar soluções", diz Weil.
Foi um longo caminho desde Mendel e seus experimentos com ervilhas. O conhecimento avançado do genoma humano significa que essas empresas - e outras como elas - vão ajudar os seres humanos a entrar em um mundo onde a medicina personalizada, adaptada aos genomas individuais, se tornará a norma.
Comentários