Estudo clínico conduzido em hospital brasileiro alcança altas taxas de resposta em pacientes com câncer hematológico avançado
O Brasil registrou um marco histórico na oncologia ao desenvolver, produzir e aplicar integralmente em território nacio
Estudo clínico conduzido em hospital brasileiro alcança altas taxas de resposta em pacientes com câncer hematológico avançado
O Brasil registrou um marco histórico na oncologia ao desenvolver, produzir e aplicar integralmente em território nacio

A parceria significa a ampliação do portfólio de pipeline da Boehringer em condições autoimunes e inflamatórias. Crédito: Michael Vi / Shutterstock.
Cue receberá um pagamento adiantado de US $ 12 milhões da Boehringer, juntamente com o apoio à pes
O acordo se baseia em uma colaboração de pesquisa existente entre a Eli Lilly e a Alchemab para descobrir novos medicamentos para ELA
A Alchemab, com sede no Reino Unido, garantiu um contrato de licenciamento no valor de até US$ 415 milhões com
NORTH CHICAGO, Ill. - A AbbVie (NYSE: ABBV) anunciou hoje a aprovação pela FDA do VYALEV™, a primeira terapia de infusão contínua subcutânea de 24 horas para adultos com doença de Parkinson avançada. Este novo tratamento foi projetado para gerenci
A Servier será responsável pelo desenvolvimento e comercialização global da terapia para várias indicações
A Servier e a Black Diamond Therapeutics assinaram um contrato de licenciamento para uma terapia direcionada, BDTX-4933, para tratar tumor

A aprovação é apoiada pelos resultados do estudo multicêntrico e aberto de Fase II Transcend FL
A Comissão Europeia (CE) concedeu aprovação ampliada à terapia com células T do receptor de antígeno quimérico (CAR) dirigido por cluster de diferenc
Takeda fará um pagamento adiantado de US$ 200 milhões à Keros.
A Takeda concordou em receber uma licença global exclusiva da Keros Therapeutics para avançar no desenvolvimento, fabricação e comercialização do inibidor experimental de ativina elr
A Biomunex pode receber até US$ 610 milhões, incluindo pagamentos adiantados e por marcos
A Ipsen firmou um contrato de licenciamento mundial exclusivo com a Biomunex Pharmaceuticals para o BMX-502, um anticorpo biespecífico de primeira classe p

A aprovação da FDA é baseada em dados fundamentais de segurança e eficácia do estudo MOVE de Fase III
A Ipsen recebeu aprovação da Food and Drug Administration (FDA) dos EUA para suas cápsulas de Sohonos (palovaroteno) para tratar pessoas com a
Elliott Mason - Corpo de Elliott Mason é incapaz de produzir fator de coagulação IX, uma proteína que ajuda a conter sangramentos, em volumes suficientes
Paciente que participou de testes disse que sua vida agora é "completamente normal", tendo
Imagem da matriz da Sarepta building em Boston. Cortesia Sarepta
O FDA dos EUA divulgou um relatório em preparação para sua decisão de 12 de maio sobre a terapia gênica da Sarepta Therapeutics para o tratamento da distrofia muscular de Duchenne (D

Foto em close-up de um homem estressado que está sofrendo de uma dor no peito e tocando sua área do coração. A cardiomiopatia hipertrófica é uma condição que afeta o coração. Crédito: damircudic via Getty Images
A FDA concedeu à terapia gênica exp
A aprovação permite que o KALYDECO seja usado em lactentes que tenham pelo menos uma mutação em seu gene regulador de condutância transmembrana da fibrose cística
A Vertex Pharmaceuticals recebeu a aprovação da Food and Drug Administration (FD
by Novartis
A Novartis anuncia que recebeu notificação oficial sobre a aprovação de preço para comercialização do medicamento tisagenlecleucel, primeira terapia com células CAR-T[1],2 do Brasil, pela Câmara de Regulação do Mercado de Medicamentos
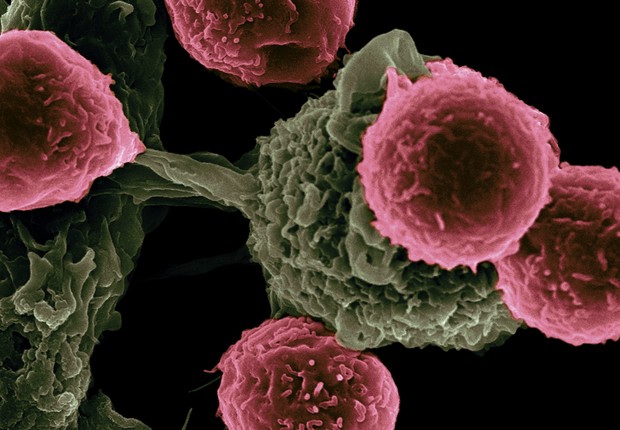
Células cancerígenas (Foto: National Cancer Institute/unsplash)
ESTADÃO CONTEÚDO
A propos
Medicina SA
O Aché Laboratórios Farmacêuticos acaba de firmar uma parceria com o McQuade Center for Strategic Research and Development (MSRD), membro do grupo Otsuka, para conduzir o desenvolvimento clínico inicial de uma terapia com potencial par
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou nesta sexta-feira (1º) o registro sanitário para um novo produto para o tratamento do mieloma múltiplo, um câncer raro das células plasmáticas, um tipo de glóbulo branco que produz anticorpo